歯周病原因子の新たな作用を解析 グラム陽性細菌による歯槽骨破壊の誘導メカニズム
歯周病原因子の新たな作用を解析
グラム陽性細菌による歯槽骨破壊の誘導メカニズム
国立大学法人bet36体育在线_bet36体育投注-官网网站@大学院工学研究院生命機能科学部門の稲田全規准教授と富成司特任助教、オックスフォード大学のYoshifumi Itoh教授、日本歯科大学の沼部幸博教授らで構成された国際共同研究チームは、歯周病における骨破壊の原因因子を検索し、グラム陽性細菌細胞壁由来のリポタイコ酸 (LTA) による歯槽骨破壊のメカニズムについて解析を行いました。本発見では、細胞や生個体を用いた特殊な歯槽骨破壊の評価系を用い、LTAが炎症性メディエーターであるプロスタグランジンE? (PGE?) を介して歯槽骨破壊に関与することが明らかとなりました。歯周病における骨破壊には、グラム陰性細菌が産生するリポ多糖 (LPS) が主な原因とされていましたが、新たにグラム陽性細菌が産生するLTAの関与が示されました。これら発見は、超高齢社会において、歯周病の新たな予防?治療法への開発へつながることも期待されます。
本研究成果は、英国の科学学術誌Scientific Reports誌(6月25日付)に掲載されました。
URL:http://www.nature.com/articles/s41598-021-92744-5
研究の背景
歯周病は細菌感染によって引き起こされる口腔局所の炎症性疾患で、歯牙の喪失を招くことで生活の質(QOL)を著しく低下させます。歯周病の骨破壊の主な原因として、歯肉縁下プラークに多く存在するグラム陰性細菌が産生するLPSが主な原因とされていますが、歯肉縁上プラーク(好気環境下)に多く存在するグラム陽性細菌が産生するLTAの詳細な役割は不明でした。bet36体育在线_bet36体育投注-官网网站@大学院工学府生命工学専攻の稲田研究室では、歯科医師である稲田准教授を中心に歯周病におけるPGE?誘導性の炎症性骨破壊の発症メカニズムを研究してきました。本研究では、オックスフォード大学、日本歯科大学との国際研究チームにより、グラム陽性細菌が産生するLTAによる歯槽骨破壊のメカニズム解明に取り組みました。
研究体制
本研究は国内外の共同研究者と連携実施したもので、詳細は以下の通りです。
- bet36体育在线_bet36体育投注-官网网站@大学院工学府生命工学専攻:稲田全規准教授、富成司特任助教、眞田歩美大学院生(当時)、平田美智子講師、市丸亮太大学院生(当時)、宮浦千里特命教授
- bet36体育在线_bet36体育投注-官网网站@グローバルイノベーション研究院:ライフサイエンス稲田全規研究ユニット
- 英国オックスフォード大学:Yoshifumi Itoh教授
- 日本歯科大学歯周病学講座:沼部幸博教授、稲田全規客員教授
研究成果
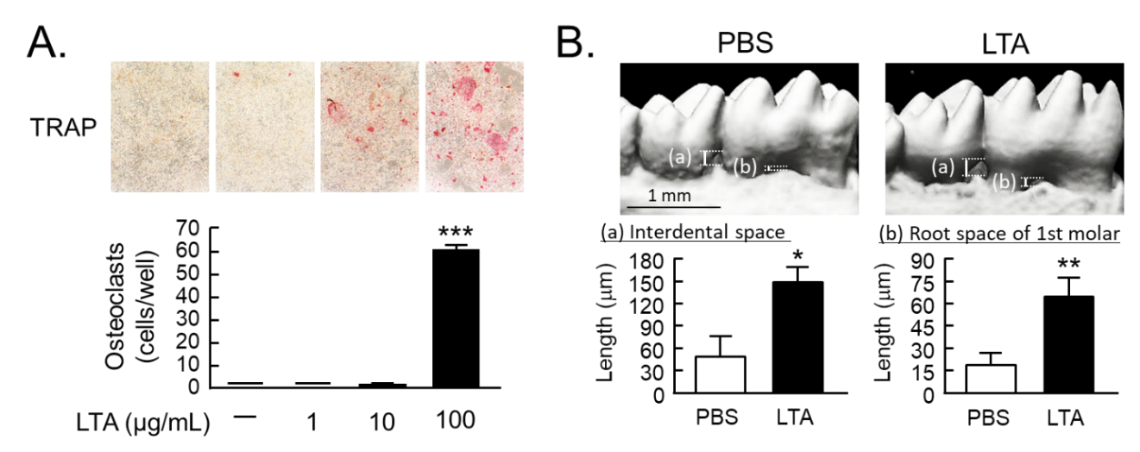
歯を支える骨は、骨を作る骨芽細胞(Osteoblast)と、骨を吸収する破骨細胞(Osteoclast)が協調して働くことで維持されています。歯周病では、グラム陰性細菌由来の細胞壁構成成分であるリポ多糖(LPS)が骨芽細胞の表面にあるTLR (toll-like receptor) 4に結合して、破骨細胞と協調して、PGE?誘導性の炎症性歯槽骨破壊を誘導することを明らかとしてきました。一方、グラム陽性細菌の細胞壁構成成分であるリポタイコ酸 (LTA) はTLR2/6に結合することが知られており、歯周病への関与が示唆されていましたが、歯槽骨破壊への詳細な関与は未だ不明でした。本研究では、骨細胞培養系(in vitro)、ならびにマウス生体(in vivo)の歯槽骨評価系を用い、LTAの作用について解析しました。結果、骨芽細胞において、LTAはNF-κB (nuclear factor kappa B)経路を介してPGE?産生を促し、破骨細胞分化誘導因子RANKL (receptor activator of NF-κB ligand) を誘導しました。一方、これらLTAの作用はPGE?の合成を抑えるCOX (cyclooxygenase) 阻害剤インドメタシンの添加によって全て抑制されました。従って、LTAはNF-κB/PGE?/RANKL経路により破骨細胞分化を誘導することが示唆されました(図1A)。また、破骨細胞単独培養系を用い、破骨細胞に対するLTAの直接作用を解析したところ、LTAは破骨細胞の延命作用を示すことが明らかとなりました。マウス骨器官(ex vivo)および生個体(in vivo)での歯周病評価系を用いた検討を行ったところ、ex vivoマウス歯槽骨器官培養系においてLTAは骨吸収活性を促進し、その作用はインドメタシンによって阻害されました。さらに、in vivoマウスモデルにおいて、歯周組織にLTAを局所投与したところ、LTAによって歯槽骨の破壊?退縮が認められました(図1B)。
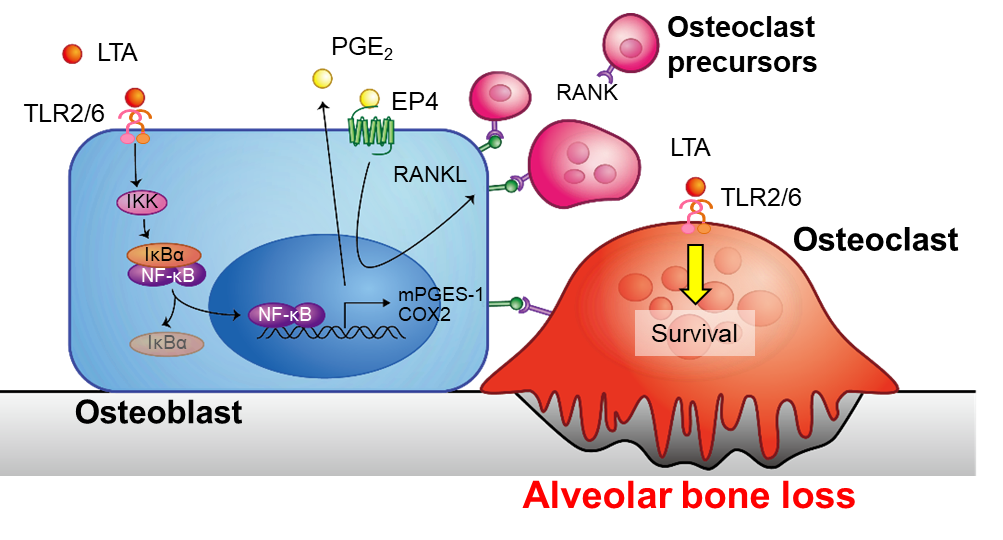
本研究により、LTAは骨芽細胞におけるPGE?を介したRANKL発現誘導および破骨細胞に対する直接的な延命作用を作用機序として、歯槽骨破壊が誘導することが明らかとなりました(図2)。グラム陰性細菌由来のLPSに加えて、グラム陽性細菌由来のLTAもPGE?を介した歯槽骨の破壊に関与することが示されたことから、今後、歯周病の新たな予防?治療法への開発へつながることも期待されます。
◆研究に関する問い合わせ◆
bet36体育在线_bet36体育投注-官网网站@大学院工学研究院
生命機能科学部門 准教授
稲田 全規(いなだ まさき)
TEL/FAX:042-388-7402
E-mail:m-inada(ここに@を入れてください)cc.jskrtf.com?
関連リンク(別ウィンドウで開きます)
- bet36体育在线_bet36体育投注-官网网站@ 稲田全規准教授 研究者プロフィール
- bet36体育在线_bet36体育投注-官网网站@ 平田美智子講師 研究者プロフィール
- bet36体育在线_bet36体育投注-官网网站@ 稲田全規准教授、平田美智子講師、富成司特任助教 研究室WEBサイト?
- 稲田全規准教授、平田美智子講師、富成司特任助教が所属する bet36体育在线_bet36体育投注-官网网站@工学部生命工学科
- bet36体育在线_bet36体育投注-官网网站@グローバルイノベーション研究院:ライフサイエンス
?
