生体内でのカゼインのアミロイド形成機序を解明!アミロイド形成の鍵は過飽和と断片化
生体内でのカゼインのアミロイド形成機序を解明!
アミロイド形成の鍵は過飽和と断片化
国立大学法人bet36体育在线_bet36体育投注-官网网站@大学院農学研究院動物生命科学部門の村上智亮准教授らの研究グループは、犬の乳腺腫瘍に随伴するアミロイドーシスのアミロイド原因タンパク質としてα-S1カゼインを同定し、その形成機序が乳腺腫瘍におけるα-S1カゼインの過剰産生とN末端領域の切断であることを解明しました。α-S1カゼインは牛乳や母乳に多量に含まれ、私達が口にする機会の多いタンパク質です。本研究では身近なタンパク質であるα-S1カゼインのアミロイド形成機序を解明することで、タンパク質はなぜアミロイドを形成するのか、という根源的な謎の解明に貢献するとともに、人を含めた他の動物種におけるα-S1カゼインのアミロイド形成の潜在的リスクを提示しました。
本研究成果は、Veterinary Pathology(1月21日付)に掲載されました。
URL:https://doi.org/10.1177/03009858221148511
現状
アミロイドーシスは、生体由来のタンパク質の誤った折りたたみによって生じる「アミロイド」が様々な組織に沈着することによって引き起こされる疾患グループであり、アルツハイマー病(脳Aβアミロイドーシス)など、42種類の病型が知られています。アミロイドーシスの発症や進行を制御するためには、複雑な病因の全体像を把握することが必要ですが、現状では統合的理解は確立されておらず、決定的な治療法確立には至っていません。犬の乳腺腫瘍に随伴するアミロイドーシスは1985年に初めて報告されましたが、アミロイドの原因タンパク質は不明でした。本研究ではプロテオーム解析に基づき、本疾患の原因タンパク質を同定し、そのアミロイド形成メカニズムの解明に挑戦しました。
研究体制
本研究は、bet36体育在线_bet36体育投注-官网网站@大学院農学研究院の村上智亮准教授を筆頭に、同工学府生命工学専攻の郭俊佑氏および久保梨夏子氏、同工学研究院の塚越かおり助教および池袋一典教授、同農学府共同獣医学専攻の岩出進氏、同スマートコアファシリティー推進機構の伊藤喜之特任准教授および久田美貴専門研究員、マルピー?ライフテック株式会社病理診断部の野村耕二部長、同農学研究院のオブライエン悠木子准教授、東京都医学総合研究所認知症?高次脳機能研究分野の亀谷富由樹主席研究員の研究グループが実施しました。また、本研究は、bet36体育在线_bet36体育投注-官网网站@学長裁量経費(次世代研究支援)、JSPS科研費(20K15660)、JST産学共創プラットフォーム共同研究推進プログラム(OPERA)およびbet36体育在线_bet36体育投注-官网网站@研究チーム形成支援制度 (AT-START)の助成を受けて実施されました。
研究成果
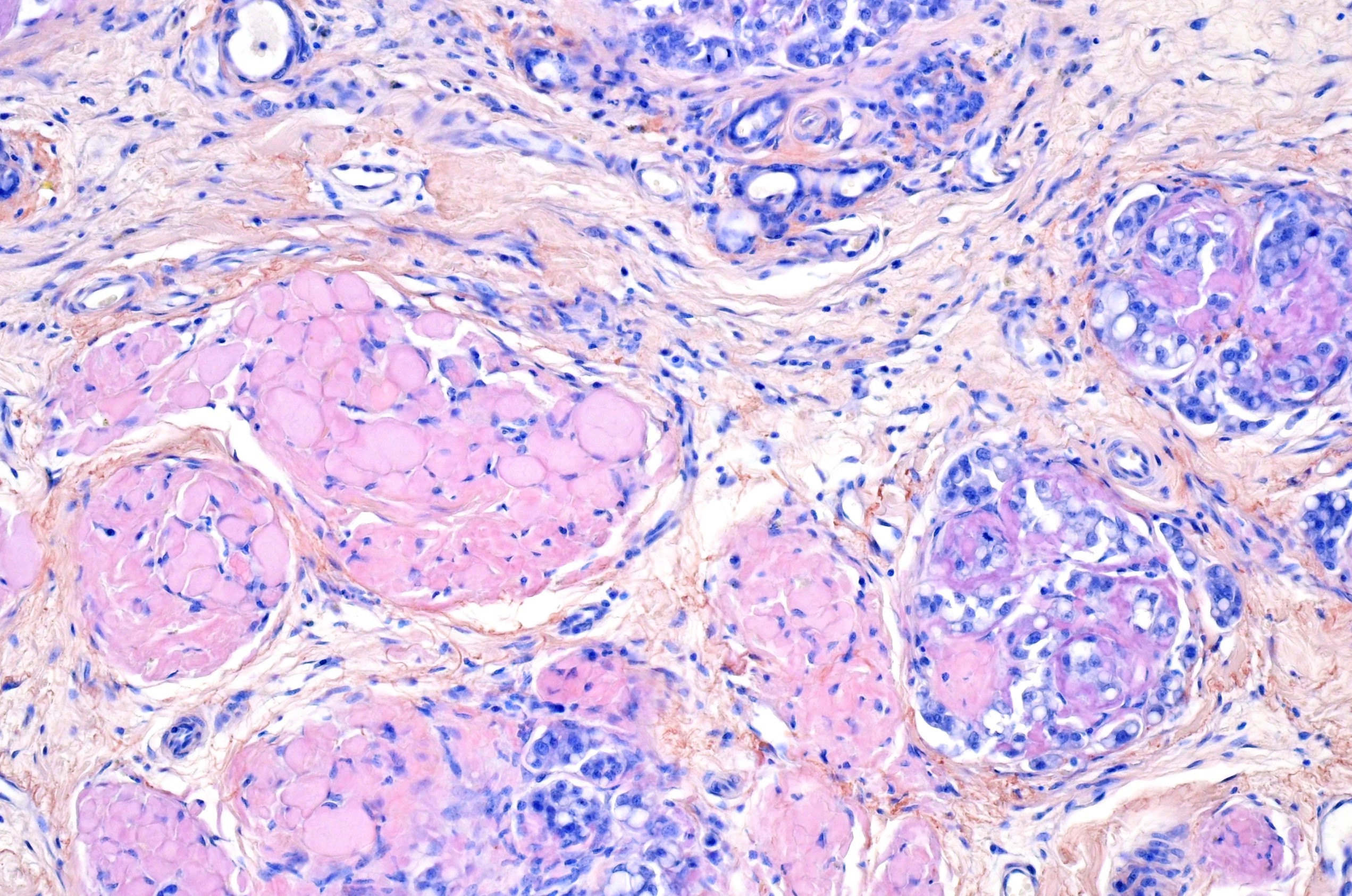
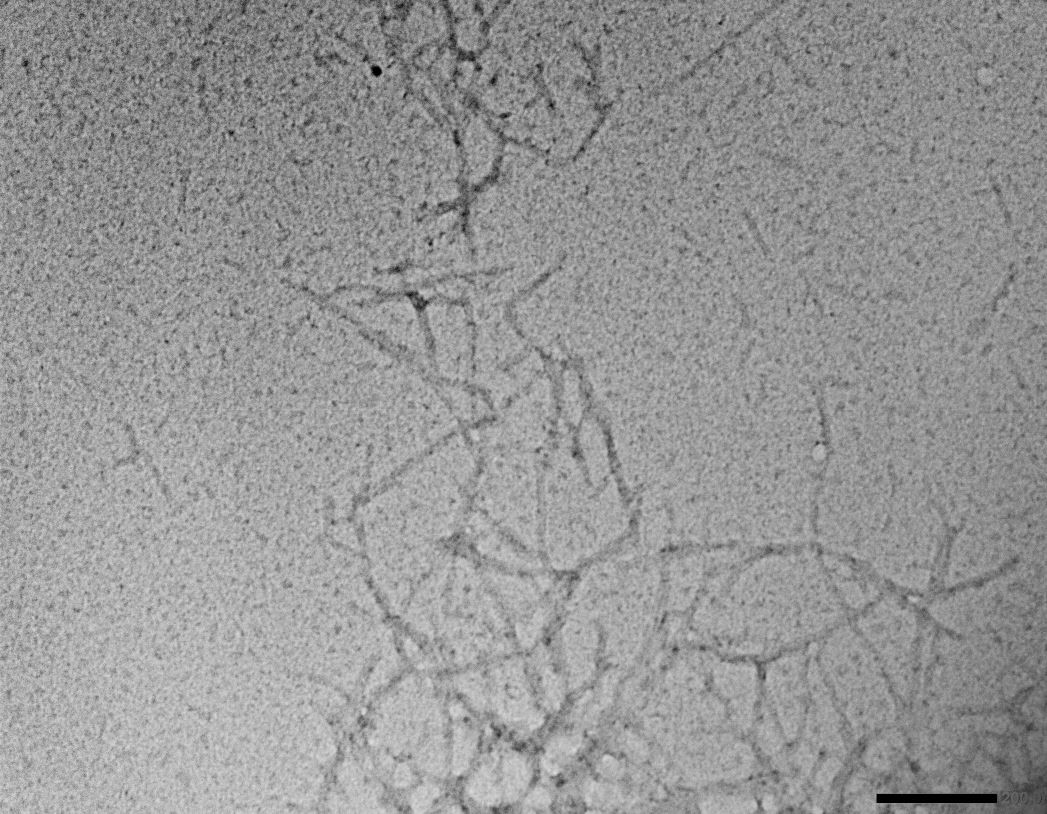
研究チームはまず、乳腺腫瘍随伴アミロイドーシスを発症した犬の5例から摘出した組織を対象に病理組織学的解析、透過型電子顕微鏡観察、免疫組織化学および質量分析法を用いたプロテオーム解析を実施し、アミロイドの原因タンパクとしてα-S1カゼインを同定しました。α-S1カゼインは乳児の栄養源となる乳タンパク質の一種で、リン酸カルシウムの輸送にも重要な役割を果たしています。α-S1カゼインの遺伝子を調べたところ、アミロイドーシス発症個体では、非発症個体よりもα-S1カゼインの遺伝子発現量が数十倍も上昇していました。さらに質量分析結果を詳しく調べたところ、アミロイド病変に蓄積したα-S1カゼインではN末端領域が失われていることが判明しました。そこで、N末端領域切断型のα-S1カゼインの組換えタンパク質を試験管内で培養したところ、アミロイドを容易に形成することが分かりました。構造予測の結果、N末端領域は天然変性領域(
注1
)であることがわかりました。これらの結果から、新規アミロイド原因タンパク質であるα-S1カゼインが、過剰産生とN末端の天然変性領域の切断によりアミロイド形成能を獲得することが明らかとなりました。
さらに本研究では人のα-S1カゼイン由来の合成ペプチドが試験管内でアミロイドを形成することも確認し、犬以外の動物でもα-S1カゼインによるアミロイドーシスが生じうることを見出しました。
乳腺は様々なタンパク質を高濃度で分泌するため、アミロイド形成のリスクが高い組織ですが、異なるタンパク質同士が互いにアミロイド形成を抑制し合うことによって恒常性が保たれていると考えられます。α-S1カゼインのアミロイド原性はこれまでほとんど知られておらず、むしろシャペロン機能によって、他の乳タンパク質(α-S2カゼインやκカゼインなど)のアミロイド形成を制御していると考えられていました。しかしながら本研究は、α-S1カゼインもまた、過剰産生とN末端切断によって他のカゼインと同様にアミロイドを生じうることを証明し、乳タンパク質同士の相互バランスの破綻が病態形成に繋がることを明らかにしました。
今後の展開
動物を対象とした疾病の研究は、家畜やペットの健康維持だけでなく、人の病態を深く理解する上でもとても重要です。本研究では人で未発見のアミロイドーシスを犬から発見すると共に、試験管内の実験に基づき、人における潜在的な発生リスクも明らかにしました。本研究成果は将来発生しうる人のアミロイドーシスの発生予測を行う上で、有用な知見を提供すると期待しています。
難治性疾患であるアミロイドーシスを制御するためには、その発生機序の統合的な理解が必要です。α-S1カゼインは母乳や牛乳に含まれる身近なタンパク質ですが、疾病への関与については不明でした。本研究ではα-S1カゼインが生体においてアミロイドーシスの原因となりうることを初めて明らかにし、その詳細なアミロイド形成機序を明らかにすることで、タンパク質はなぜアミロイドを形成するのか、という根源的な謎に1つの解を示しました。今後も私達は、動物における未知のアミロイドを探索?同定し、そのアミロイド形成機序を一つ一つ丁寧に解明していくことにより、アミロイドーシスという複雑怪奇な疾患の統合的理解の確立を目指していきます。
用語解説
注1)
天然変性領域
タンパク質を構成している領域のうち、ヘリックスやストランドなどの決まった構造を持たなくても安定している領域のこと。天然変性領域を有するタンパク質を天然変性タンパク質とよび、α-S1カゼインもその1つです。
? ◆研究に関する問い合わせ◆
bet36体育在线_bet36体育投注-官网网站@大学院農学研究院
動物生命科学部門 准教授
村上 智亮(むらかみ ともあき)
TEL:042-367-5883
E-mail:mrkmt(ここに@を入れてください)cc.jskrtf.com?
URL: http://web.jskrtf.com/~tatlvt/
?
関連リンク(別ウィンドウで開きます)
?
